中國臨床研究服務業
藥物研發流程
過程中涉及研發和對候選藥物進行測試,以證明其安全性和有效性,從而獲得監管機構批准進入市場。 此過程通常是昂貴、複雜、存在風險和耗時的,整個過程通常包括四個階段,分別是(i)發現、(ii)臨床前、(iii)臨床和註冊,包括I至IV期臨床試驗和(iv)製造。
研發外判服務
藥品研發過程的複雜、存在風險、耗時和昂貴的性質對藥品研發外判服務產生了巨大的需求。 此類服務由兩種類型的藥品研發外判服務商提供,分別是CROs(合同研究組織)和CDMOs(合同開發製造組織)。 CROs為製藥公司提供各種研發的服務,包括研發、臨床前以及臨床和註冊階段,而CDMOs在製造階段主要從事CMC(化學、製造和控制)的服務。
隨著製藥行業不斷發展,CROs在需要大量資本、複雜、存在風險和耗時的製藥研發過程中發揮著越來越重要的作用。 CROs提供全面的研發解決方案,涵蓋(i)發現階段、(ii)臨床前階段和(iii)臨床階段,包括I至IV期臨床試驗。
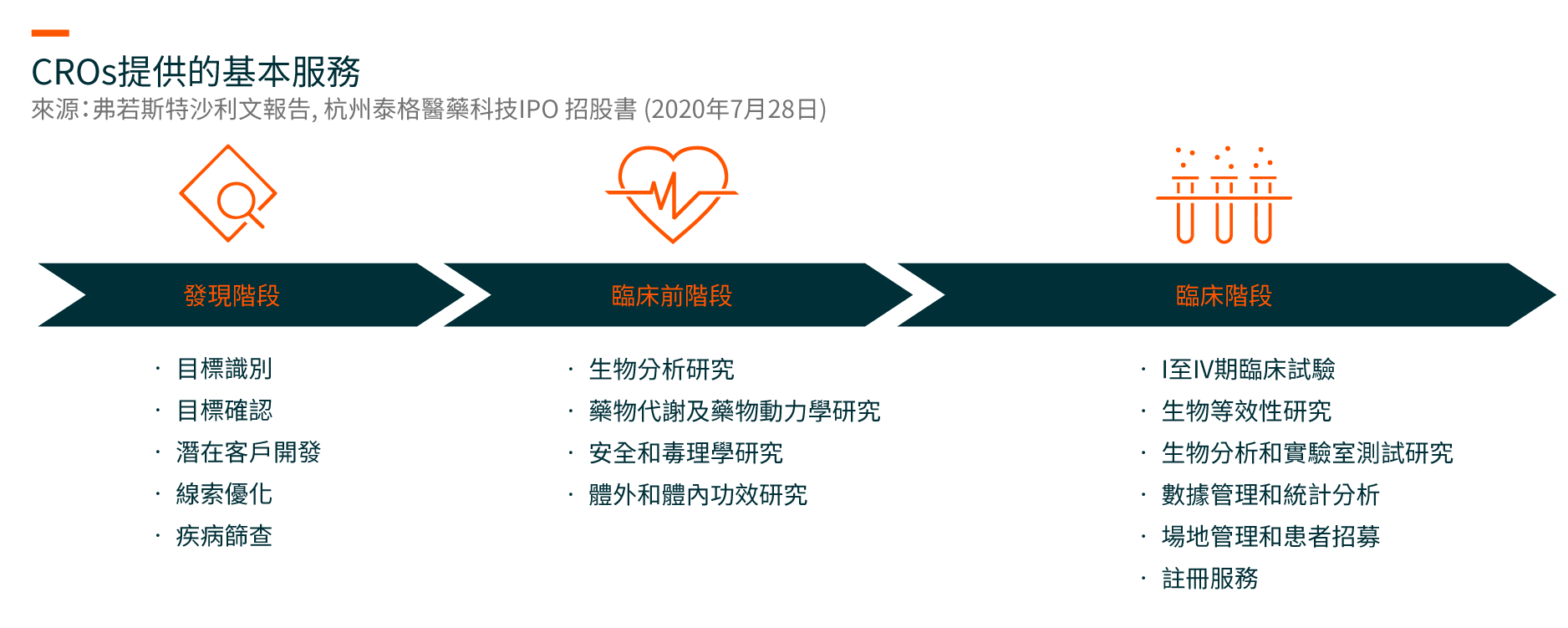
製藥公司依靠具有強大項目管理和科學專業知識,專業經驗豐富的人才庫,創新技術和豐富監管經驗的CROs來管理複雜的項目,以降低研發風險和成本,並加快開發安全有效藥物。
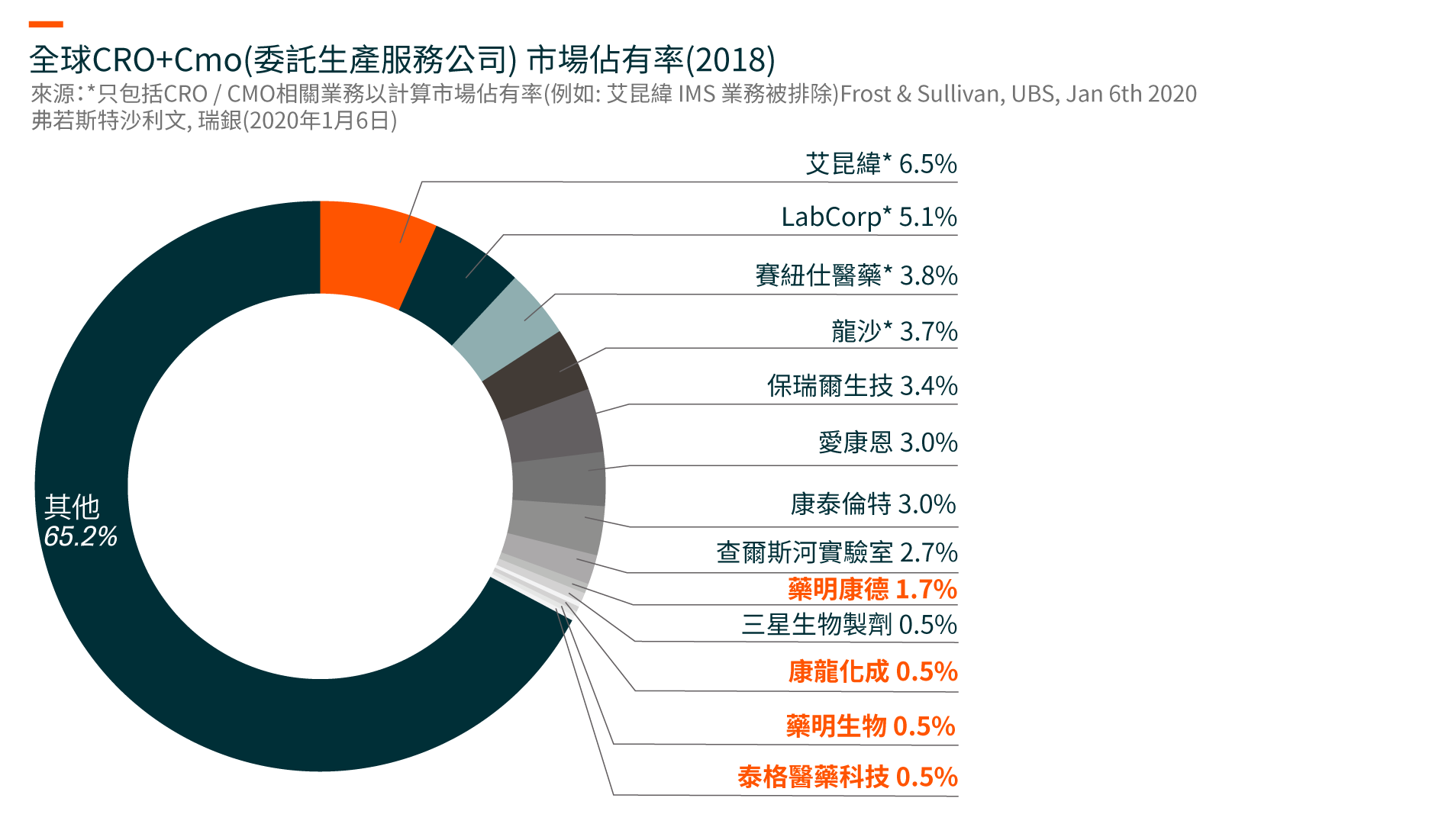
推動全球以及中國醫藥研發服務市場增長的關鍵因素包括:
- 增加研發支出,推動CROs的增長。
- 研發過程的複雜性越來越高–這導致許多製藥公司將更多的研發活動外判給具有先進技術及經驗豐富的CROs。
- 節省成本–面對新藥開發競爭日益激烈和研發收益降低的情況下,CROs幫助他們高效,專業地管理研發活動,同時降低成本和風險。
- 新興的生物技術公司–尤其是在中國湧現了許多生物技術公司,由於內部資源和能力有限,許多新興生物技術公司都嚴重依賴第三方服務提供商來指導其複雜的研發項目,從而產生了對CRO服務的額外需求。
- 中國政府的優惠政策–中國政府已對監管審查和批准制度進行了改革,並涵蓋了整個中國醫藥市場的價值鏈,從臨床試驗、監管提交、製造到醫療保險都有覆蓋。 改革為專門從事創新藥物開發的CROs帶來了更多的商機,當中中國發佈了各種有利的政策來鼓勵藥品CRO市場的發展,例如在2017年發佈的《國際外包服務業發展第十三個五年計劃》。
按地區劃分的市場規模
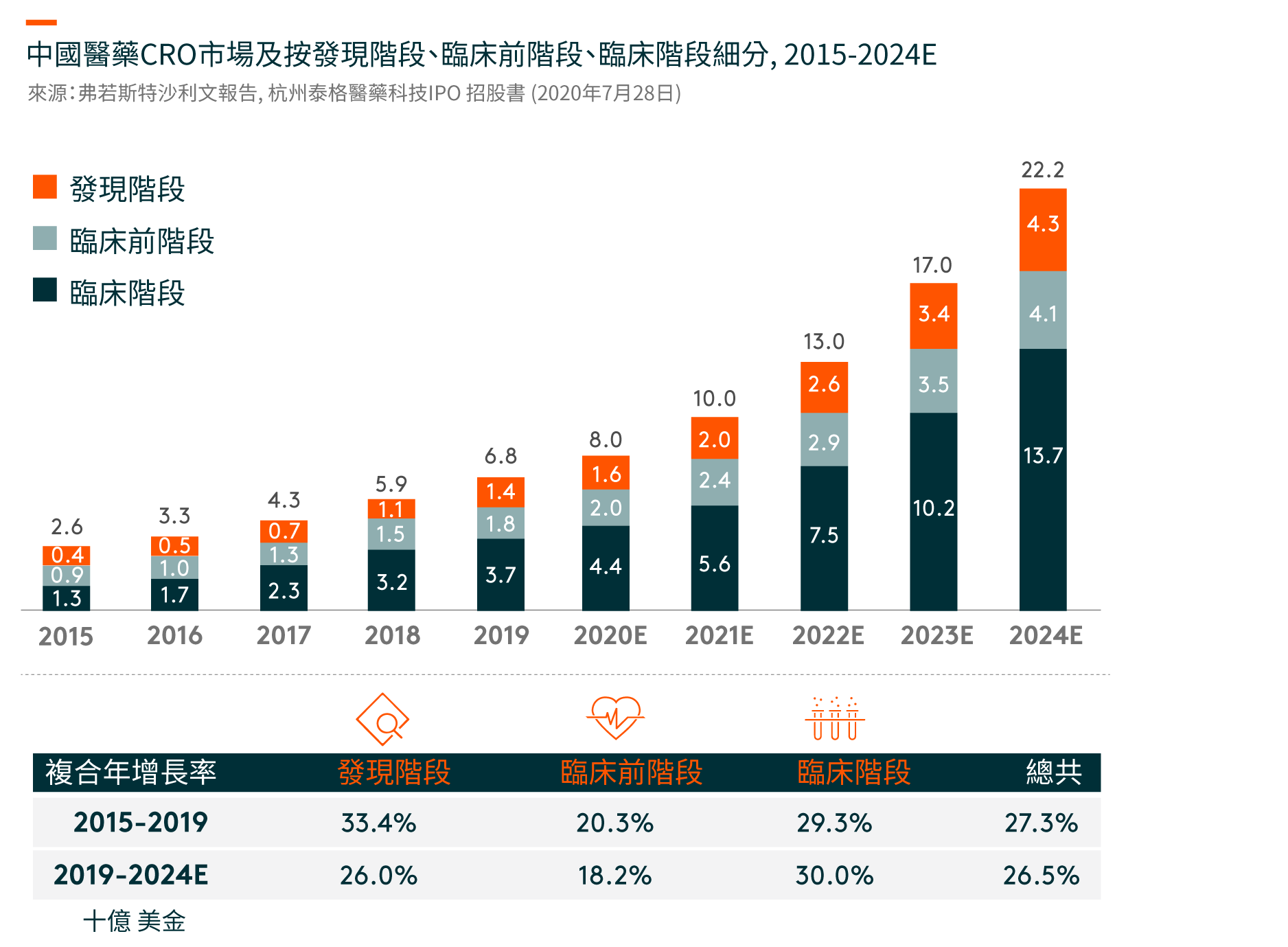
美國是最大的臨床CRO市場,在2019年將達到209億美元,並預計在2019-24年期間將以8%的複合年增長率(CAGR)增長。 儘管中國的臨床CRO市場尚處於早期階段,但預計將從2019年的37億美元迅速增長到2024年的137億美元,複合年增長率為30%。
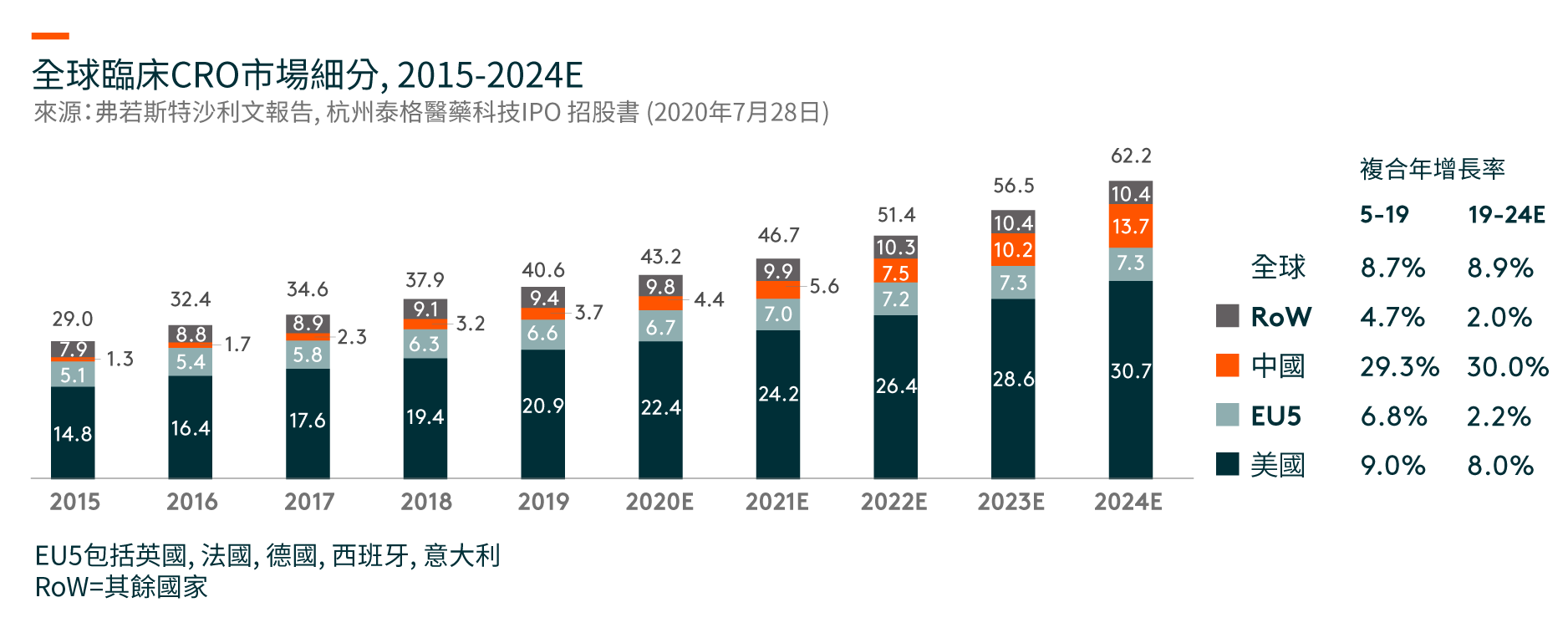
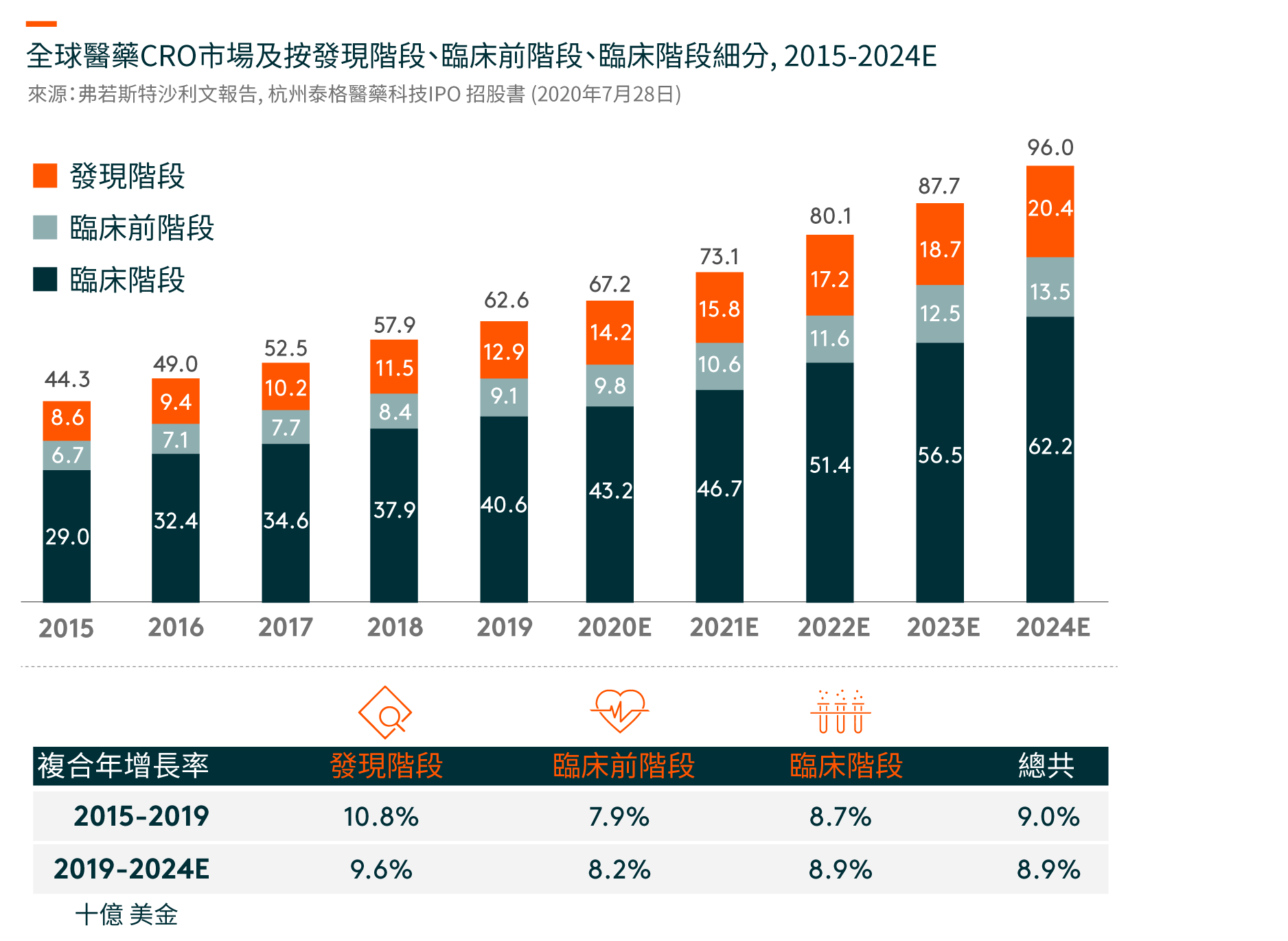
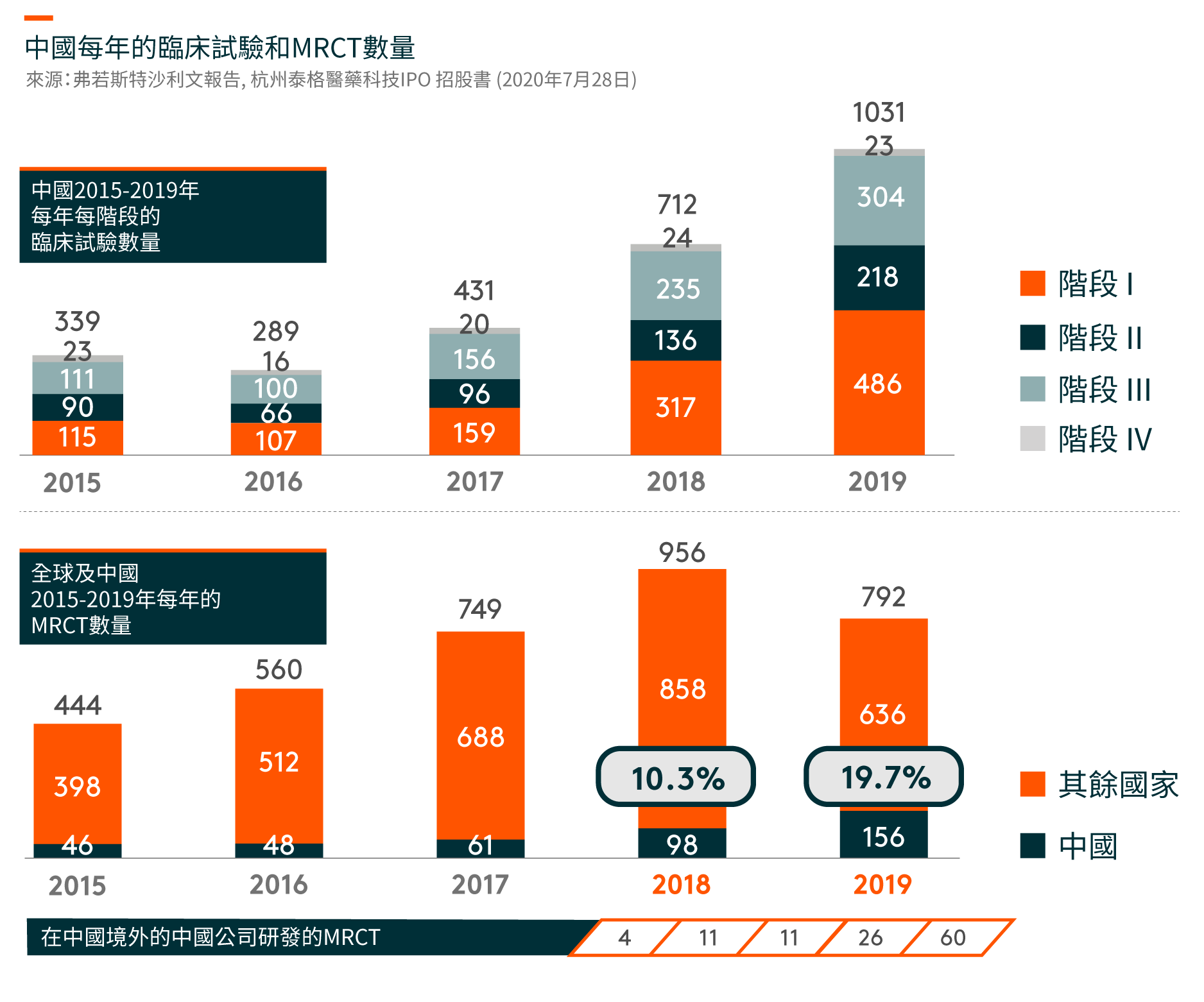
在中國,臨床試驗的數量從2015年的339項增加到2019年的1,031項。隨著藥物研發的不斷全球化和中國成為全球藥物研發行業不可或缺的一部分,在中國進行多區域臨床試驗(MRCTs)的數量也有所增加。自中國於2017年加入ICH(人類使用藥品註冊的技術要求國際會議)(一個旨在統一不同國家對藥品開發和註冊的技術和法規要求的組織),中國一直在更新和遵循適用於成熟市場藥品臨床開發的法規,海外產生的臨床數據亦可以用作補充數據以支持中國的註冊申請。另一方面,跨國製藥公司在中國進行臨床試驗的MRCTs越來越多,從以支持其向NMPA(國家藥品監督管理局,前稱中國食品藥品監督管理局)的註冊申請。
相關ETF
Global X中國生物科技ETF 使投資者能夠投資於對中國生物技術發展至關重要的公司,以獲得高增長潛力。。
其他特徵
- 集中投資: 該基金針對新興主題和行業進行針對性的投資。
- ETF的投資便利:透過一次買賣交易,該基金可以投資於數十家以中國生物科技為主題的公司。
請點擊此處以了解更多有關Global X中國生物科技ETF 的資料。


